Gebrauchsinformationen: Informationen für Anwender
cutaquig®, 165 mg/ml, Injektionslösung
Normales Immunglobulin vom Menschen zur subkutanen Injektion (SCIg)
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Sie können dabei helfen, indem Sie jede auftretende Nebenwirkung melden. Hinweise zur Meldung von Nebenwirkungen, siehe Ende Abschnitt 4.
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist cutaquig® und wofür wird es angewendet
Was cutaquig® ist
cutaquig® gehört zu einer Klasse von Arzneimitteln, die als „normale Immunglobuline vom Menschen“ bezeichnet werden. Immunglobuline, auch als Antikörper bekannt, sind Eiweißkörper, die im Blut gesunder Menschen vorhanden sind. Antikörper sind Teil des Immunsystems (die natürliche Abwehr des Körpers) und helfen Ihrem Körper bei der Bekämpfung von Infektionen.
Wie cutaquig® wirkt
cutaquig® enthält Immunglobuline, die aus dem Blut gesunder Menschen gewonnen werden. Das Arzneimittel wirkt genauso wie die Immunglobuline, die natürlicherweise in Ihrem Blut vorhanden sind.
Wofür cutaquig® angewendet wird
cutaquig® wird bei Patienten angewendet, die nicht über genügend Antikörper im Blut verfügen, um Infektionen abzuwehren, und deshalb dazu neigen, häufig an Infektionen zu erkranken. Regelmäßige und ausreichende Dosen von cutaquig® können krankhaft erniedrigte Immunglobulinspiegel in Ihrem Blut auf Normalwerte anheben (Ersatztherapie).
cutaquig® wird Erwachsenen sowie Kindern und Jugendlichen (0-18 Jahre) in folgenden Situationen verschrieben:
- Behandlung von Patienten mit einer angeborenen verringerten Fähigkeit oder Unfähigkeit, Antikörper zu bilden (primäre Immunmangelkrankheiten). Patienten mit einem erworbenen Mangel an Antikörpern (sekundäre Immunmangelkrankheiten) aufgrund von spezifischen Erkrankungen und/oder Behandlungen und mit schweren oder häufigen Infektionen.
2. Was sollten Sie vor der Anwendung von cutaquig® beachten?
cutaquig® darf NICHT angewendet werden,
- wenn Sie allergisch gegen normale Immunglobuline vom Menschen oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
cutaquig® NICHT in ein Blutgefäß injizieren.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie cutaquig® anwenden.
Sie können allergisch (überempfindlich) gegen Immunglobuline sein, ohne es zu wissen. Echte allergische Reaktionen wie zum Beispiel ein plötzlicher Blutdruckabfall oder ein anaphylaktischer Schock (ein starker Blutdruckabfall zusammen mit anderen Symptomen wie Rachenschwellung, Atembeschwerden und Hautausschlag) sind selten, können aber gelegentlich auftreten, selbst wenn Sie bereits früher Immunglobuline vom Menschen erhalten und diese gut vertragen haben. Sie können besonders dann auftreten, wenn in Ihrem Blut nicht genug des Immunglobulins Typ A (IgA) vorhanden ist (IgA-Mangel) und Sie Antikörper gegen IgA aufweisen.
- Informieren Sie Ihren Arzt oder das medizinische Fachpersonal vor der Behandlung, wenn Sie einen Immunglobulin-Typ-A(IgA)-Mangel haben. cutaquig® enthält Restmengen an IgA, die zu einer allergischen Reaktion führen könnten. In diesen seltenen Fällen können allergische Reaktionen wie ein plötzlicher Blutdruckabfall oder Schock auftreten (siehe auch Abschnitt 4). Zu den Anzeichen und Symptomen dieser seltenen allergischen Reaktionen gehören
- Benommenheit, Schwindel oder Schwächegefühl
- Hautausschlag und Juckreiz, Schwellung im Mund oder Rachenraum, Atembeschwerden, pfeifende Atemgeräusche
- Abnorme Herzfrequenz, Schmerzen im Brustraum, blaue Lippen oder Finger und Zehen
- Verschwommenes Sehen
Informieren Sie umgehend Ihren Arzt, wenn Sie während der Injektion von cutaquig® solche Anzeichen bemerken. Er wird entscheiden, ob die Injektionsgeschwindigkeit verringert oder die Injektion ganz abgebrochen werden muss.
- Informieren Sie Ihren Arzt, wenn Sie in der Vergangenheit eine Herz- oder Gefäßerkrankung oder Blutgerinnsel (Thrombosen) hatten, Ihr Blut dickflüssig ist oder Sie längere Zeit bettlägerig waren. Diese Umstände können Ihr Risiko für die Bildung eines Blutgerinnsels nach der Anwendung von cutaquig® erhöhen. Teilen Sie Ihrem Arzt auch mit, welche Medikamente Sie anwenden, da einige, wie zum Beispiel Medikamente, die das Hormon Östrogen enthalten (beispielsweise die „Pille“ zur Empfängnisverhütung), Ihr Risiko einer Blutgerinnselbildung erhöhen können. Wenden Sie sich umgehend an Ihren Arzt, wenn bei Ihnen nach der Anwendung von cutaquig® Anzeichen und Symptome wie zum Beispiel Kurzatmigkeit, Schmerzen im Brustraum, Schmerzen und Schwellung eines Armes oder Beines sowie Schwäche oder Taubheitsgefühl in einer Körperseite auftreten.
- Sprechen Sie mit Ihrem Arzt, wenn bei Ihnen nach der Anwendung von cutaquig® die folgenden Anzeichen und Symptome auftreten: starke Kopfschmerzen, Nackensteifigkeit, Benommenheit, Fieber, übermäßige Lichtempfindlichkeit, Übelkeit und Erbrechen. Dies können Symptome einer aseptischen Meningitis sein. Ihr Arzt wird entscheiden, ob weitere Untersuchungen erforderlich sind und ob die Behandlung mit cutaquig® fortgesetzt werden sollte.
- cutaquig® enthält Blutgruppenantikörper, die rote Blutkörperchen zerstören und dadurch eine Anämie (verminderte Anzahl an roten Blutkörperchen) hervorrufen können.
Ihr Arzt oder das medizinische Fachpersonal werden mögliche Komplikationen vermeiden, indem sichergestellt wird, dass:
- Sie nicht überempfindlich auf normales Immunglobulin vom Menschen reagieren. Das Arzneimittel muss anfangs langsam infundiert werden. Die in Abschnitt 3 empfohlene Injektionsgeschwindigkeit muss genau eingehalten werden.
- Sie während der gesamten Injektionsdauer sorgfältig auf das Auftreten von Symptomen überwacht werden, insbesondere wenn:
- Sie normales Immunglobulin vom Menschen zum ersten Mal erhalten
- Sie von einem anderen Medikament auf cutaquig® umgestellt wurden
- seit Ihrer letzten Injektion ein längerer Zeitraum vergangen ist (mehr als acht Wochen)
In diesen Fällen wird empfohlen, dass Sie während der ersten Injektion und der ersten Stunde danach überwacht werden. Treffen die oben genannten Punkte nicht auf Sie zu, wird empfohlen, dass Sie nach der Verabreichung mindestens 20 Minuten lang beobachtet werden.
Kinder und Jugendliche
Die aufgeführten Warnhinweise und Vorsichtsmaßnahmen gelten für Erwachsene, Kinder und Jugendliche.
Anwendung von cutaquig® zusammen mit anderen Arzneimitteln
- Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen, andere Arzneimittel anzuwenden.
- Sie dürfen cutaquig® nicht mit anderen Arzneimitteln mischen.
- Informieren Sie Ihren Arzt vor einer Impfung über Ihre Behandlung mit cutaquig®. cutaquig® (wie alle normalen Immunglobuline vom Menschen) kann die Wirksamkeit einiger Lebendimpfstoffe gegen Viruskrankheiten wie beispielsweise gegen Masern, Röteln, Mumps und Windpocken beeinträchtigen. Daher müssen Sie nach Gabe von cutaquig® möglicherweise bis zu 3 Monate warten, bevor Sie mit einem Lebendimpfstoff geimpft werden können. Bei einer Masernimpfung kann diese Beeinträchtigung bis zu einem Jahr anhalten.
- Blutzuckertest
Einige Arten von Blutzuckertestsystemen (so genannte Glukometer) interpretieren die Maltose, die in cutaquig® enthalten ist, fälschlicherweise als Glucose. Das kann nach sich ziehen, dass der Glucosewert während einer Injektion sowie bis etwa 15 Stunden nach Ende der Injektion fälschlicherweise erhöht angezeigt wird. Dies kann dazu führen, dass eine unangemessene Menge Insulin verabreicht wird, was zu einer lebensbedrohlichen Unterzuckerung (d. h. vermindertem Blutzuckerspiegel) führen kann. Andererseits können Fälle einer echten Unterzuckerung unbehandelt bleiben, wenn die Unterzuckerung durch den fälschlich erhöhten Glucosetest verschleiert wird. Infolgedessen muss die Blutzuckerbestimmung, wenn cutaquig® oder andere maltosehaltige Produkte verabreicht werden, mit einem Testsystem durchgeführt werden, das eine glucosespezifische Methode verwendet. Systeme, die mit der Glucosedehydrogenase- Pyrrolochinolinchinon- (GDH-PQQ) oder Glucose-Dye-Oxidoreduktase-Methode arbeiten, dürfen nicht verwendet werden. Lesen Sie sorgfältig die Gebrauchsinformation des Blutzuckertestsystems und der Teststreifen, um sicherzustellen, dass das System für die Verwendung mit maltosehaltigen parenteralen Produkten geeignet ist. Bei Unklarheiten fragen Sie bitte Ihren behandelnden Arzt, um sicherzustellen, dass das Glucosetestsystem, das Sie verwenden, auch tatsächlich für den Gebrauch mit maltosehaltigen parenteralen Produkten geeignet ist.
Anwendung von cutaquig® zusammen mit Nahrungsmitteln, Getränken und Alkohol
Es wurden keine Auswirkungen beobachtet.
Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Dieses Arzneimittel sollte nur nach Rücksprache mit Ihrem Arzt oder Apotheker während der Schwangerschaft oder Stillzeit angewendet werden.
Es wurden keine klinischen Studien mit cutaquig® bei schwangeren Frauen durchgeführt. Allerdings wurden Arzneimittel, die Immunglobuline enthalten, seit Jahren bei schwangeren und stillenden Frauen angewendet und keine schädlichen Wirkungen auf den Schwangerschaftsverlauf oder das Neugeborene beobachtet.
Wenn Sie stillen und cutaquig® erhalten, ist das Immunglobulin aus dem Arzneimittel auch in der Muttermilch enthalten. Daher kann ihr Baby vor bestimmten Infektionen geschützt sein.
Die Erfahrung mit Immunglobulinen deutet darauf hin, dass keine schädlichen Wirkungen auf die Fortpflanzungsfähigkeit zu erwarten sind.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen können durch einige mit cutaquig® einhergehende Nebenwirkungen beeinträchtigt werden. Patienten, bei denen während der Behandlung Nebenwirkungen auftreten, sollten erst wieder ein Fahrzeug führen oder Maschinen bedienen, wenn diese abgeklungen sind.
cutaquig® enthält Natrium
Dieses Arzneimittel enthält 33,1 mg Natrium (Hauptbestandteil von Kochsalz/Speisesalz) pro Durchstechflasche mit 48 ml und 13,8 mg pro Durchstechflasche mit 20 ml. Dies entspricht 1,7 % bzw. 0,7 % der für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung.
Informationen darüber, woraus cutaquig® hergestellt wird
cutaquig® wird aus Blutplasma vom Menschen (das ist der flüssige Bestandteil des Blutes) hergestellt. Bei der Herstellung von Arzneimitteln aus Blut oder Plasma vom Menschen werden bestimmte Maßnahmen ergriffen, um eine Übertragung von Infektionen auf den Patienten zu verhindern. Diese umfassen:
- die sorgfältige Auswahl der Spender von Blut und Plasma, um sicherzustellen, dass Personen, bei denen das Risiko von Infektionen besteht, ausgeschlossen werden,
- die Untersuchung jeder Spende und der Plasmapools auf Anzeichen von Viren/Infektionen,
- Herstellungsschritte in der Verarbeitung von Blut oder Plasma, welche Viren inaktivieren oder entfernen.
Trotz dieser Maßnahmen kann bei der Verabreichung von Arzneimitteln, die aus Blut oder Plasma vom Menschen hergestellt werden, die Möglichkeit der Übertragung von Infektionen nicht völlig ausgeschlossen werden. Dies betrifft auch unbekannte oder neu aufgetretene Viren bzw. andere Infektionsarten.
Die getroffenen Maßnahmen gelten bei umhüllten Viren wie zum Beispiel humanem Immundefizienz- Virus (HIV – das Virus, das AIDS verursacht), Hepatitis-B-Virus und Hepatitis-C-Virus als wirksam. Die getroffenen Maßnahmen können bei nicht umhüllten Viren wie zum Beispiel Hepatitis-A-Virus und Parvovirus B19 von begrenztem Nutzen sein.
Immunglobuline wurden nicht mit Hepatitis-A- oder Parvovirus-B19-Infektionen in Zusammenhang gebracht, was möglicherweise daran liegt, dass die in diesen Produkten enthaltenen Antikörper gegen diese Infektionen schützend wirken.
Es wird dringend empfohlen, jedes Mal, wenn Sie eine Dosis cutaquig® erhalten, den Namen und die Chargennummer des Arzneimittels zu vermerken, um eine Aufzeichnung der verwendeten Chargen zu erhalten (siehe auch Anhang I: Anleitung zur Anwendung).
3. Wie ist cutaquig® anzuwenden?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. cutaquig® muss unter die Haut injiziert werden (subkutane bzw. s.c. Anwendung).
Die Behandlung wird von Ihrem Arzt oder einer medizinischen Fachkraft eingeleitet, die in der Behandlung von Patienten mit einem Immunglobulinmangel erfahren ist.
Nachdem Ihr Arzt oder die medizinische Fachkraft die richtige Dosis und Injektionsgeschwindigkeit für Sie festgelegt hat und Sie die ersten Injektionen unter Aufsicht erhalten haben, dürfen Sie sich möglicherweise die Behandlung selbst zu Hause verabreichen oder sie zu Hause von Ihrer (geschulten) Betreuungsperson erhalten. Ihr Arzt oder die medizinische Fachkraft mit Erfahrungen in der Anleitung von Patienten zur häuslichen Behandlung werden sicherstellen, dass Sie oder Ihre Betreuungsperson geschult werden und über Folgendes genaue Informationen erhalten:
- Keimfreie (aseptische) Injektionstechnik
- Handhabung des Injektionsgerätes (falls erforderlich)
- Führen eines Behandlungstagebuchs
- Zu ergreifende Maßnahmen im Falle von schwerwiegenden Nebenwirkungen (siehe auch Abschnitt 4)
Sobald Sie in der Lage sind, sich selbst zu behandeln, und während der Behandlung keine Nebenwirkungen aufgetreten sind, wird Ihnen Ihr Arzt möglicherweise erlauben, die Behandlung zu Hause fortzusetzen.
Dosierung
Ihre individuelle Dosierung und die Injektionsgeschwindigkeit wird von Ihrem Arzt ermittelt, der die Dosis speziell für Sie unter Berücksichtigung Ihres Körpergewichts, möglicher vorangegangener Behandlungen und Ihres Ansprechens auf die Behandlung anpassen wird. Befolgen Sie immer die Anweisungen Ihres Arztes.
Substitutionstherapie bei primären Immunmangelsyndromen:
Ihr Arzt wird festlegen, ob Sie eine Anfangsdosis (für Erwachsene und Kinder) von mindestens 1,2 bis 3,0 ml/kg Körpergewicht, verteilt über mehrere Tage, benötigen. Anschließend werden Sie Cutaquig regelmäßig von täglich bis zu alle 2 Wochen erhalten. Die monatliche Gesamtdosis wird 2,4 bis 4,8 ml/kg Körpergewicht betragen. Ihr Arzt wird Ihre Dosis möglicherweise je nach Ihrem Ansprechen auf die Behandlung anpassen.
Substitutionstherapie bei sekundären Immunmangelsyndromen:
Empfohlen wird diejenige (Einzel-)Dosis, durch die nach Verabreichung bei wiederholten Intervallen (etwa einmal pro Woche) eine kumulative monatliche Dosis im Bereich von 0,2 – 0,4 g/kg (1,2 – 2,4 ml/kg) erreicht wird. Für jede Einzeldosis muss möglicherweise die Injektionsstelle gewechselt werden. Ihr Arzt kann Ihre Dosis in Abhängigkeit von Ihrem Ansprechen auf die Behandlung anpassen.
Ändern Sie die Dosis oder die Abstände zwischen den Dosen nicht ohne Rücksprache mit Ihrem Arzt. Wenn Sie denken, dass Sie Cutaquig häufiger oder weniger häufig erhalten sollten, sprechen Sie bitte mit Ihrem Arzt. Wenn Sie glauben, dass Sie eine Dosis vergessen haben, sprechen Sie bitte so bald wie möglich mit Ihrem Arzt.
Art der Anwendung und Verabreichungsweg
Auswahl der Injektionsstelle(n)
Geeignete Bereiche für die subkutane Injektion von cutaquig® sind Bauch, Oberschenkel, Oberarme oder seitliche Hüfte. Es können mehrere Injektionsstellen gleichzeitig verwendet werden. Die Anzahl der Injektionsstellen ist nicht begrenzt, aber der Abstand zwischen den Injektionsstellen sollte mindestens 5 cm betragen. Wechseln Sie regelmäßig die Injektionsstellen, wie von Ihrem Arzt oder der medizinischen Fachkraft empfohlen.
Die pro Injektionsstelle verabreichte Menge ist unterschiedlich, aber es wird empfohlen, große Injektionsvolumen (> 30 ml) auf mehrere Injektionsstellen zu verteilen. Bei Säuglingen und Kindern können die Injektionsstellen alle 5-15 ml gewechselt werden.
Injektionsgeschwindigkeit
Die empfohlene anfängliche Injektionsgeschwindigkeit beträgt 15 ml/Stunde/Injektionsstelle. Bei guter Verträglichkeit können Sie die Injektionsgeschwindigkeit schrittweise auf 25 ml/Stunde/Injektionsstelle erhöhen.
Empfohlene Injektionsgeschwindigkeit für alle Injektionsstellen kombiniert: 30 ml/Stunde für die ersten 6 Injektionen, dann schrittweise Erhöhung auf 50 ml/Stunde und bei guter Verträglichkeit auf 80 ml/Stunde.
Ausführliche Anweisungen für die Anwendung finden Sie weiter unten.
cutaquig® ist nur zur subkutanen (unter die Haut) Anwendung bestimmt. Sie dürfen cutaquig® nicht in ein Blutgefäß injizieren.
Wenden Sie cutaquig® nur zu Hause an, wenn Sie von Ihrem Arzt oder dem medizinischen Fachpersonal ausreichend unterwiesen und geschult wurden.
Befolgen Sie die Anleitung zur Anwendung am Ende der Packungsbeilage (Anhang I) Schritt für Schritt und verwenden Sie bei der Verabreichung von cutaquig® aseptische/sterile Techniken.
Verwenden Sie bei der Vorbereitung der Injektion Handschuhe, wenn Sie dazu aufgefordert wurden.
Anwendung bei Kindern und Jugendlichen
Für Kinder und Jugendliche (0 bis 18 Jahre) gelten die gleichen Anwendungsgebiete, Dosen und die gleiche Häufigkeit von Injektionen wie für Erwachsene.
Wenn Sie eine größere Menge von cutaquig® angewendet haben, als Sie sollten
Wenn Sie annehmen, dass Sie sich zu viel cutaquig® verabreicht haben, sprechen Sie sobald wie möglich mit Ihrem Arzt.
Wenn Sie die Anwendung von cutaquig® vergessen haben
Wenn Sie eine Dosis vergessen haben, informieren Sie so bald wie möglich Ihren Arzt oder das medizinische Fachpersonal. Wenden Sie nicht die doppelte Menge von cutaquig® an, wenn Sie die vorherige Anwendung vergessen haben.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Dazu gehören zum Beispiel Schüttelfrost, Kopfschmerzen, Schwindel, Fieber, Erbrechen, allergische Reaktionen, Übelkeit, Gelenkschmerzen, niedriger Blutdruck und mäßige Schmerzen im unteren Rücken.
Bestimmte Nebenwirkungen wie Kopfschmerzen, Schüttelfrost oder Körperschmerzen können durch Verlangsamung der Injektionsgeschwindigkeit vermindert werden.
In klinischen Studien zur Untersuchung der Sicherheit bei der Anwendung von cutaquig® wurden keine mit cutaquig® in Zusammenhang stehenden schwerwiegenden Nebenwirkungen beobachtet.
Sie können allergisch (überempfindlich) gegen Immunglobuline sein und es kann zu allergischen Reaktionen wie einem plötzlichen Blutdruckabfall sowie in Einzelfällen zu einem Schock kommen. Ärzte sind mit diesen Nebenwirkungen vertraut und werden Sie während und nach den ersten Injektionen überwachen.
Informieren Sie umgehend Ihren Arzt, wenn Sie Folgendes bemerken:
- Benommenheit, Schwindel oder Schwächegefühl,
- Hautausschlag und Juckreiz, Schwellung im Mund oder Rachenraum, Atembeschwerden, pfeifende Atemgeräusche,
- Abnorme Herzfrequenz, Schmerzen im Brustraum, blaue Lippen oder Finger und Zehen,
- Verschwommenes Sehen.
Wenn Sie cutaquig® zu Hause anwenden, werden Sie die Injektion möglicherweise in Gegenwart Ihrer Betreuungsperson durchführen, die Sie dabei unterstützt, auf Anzeichen einer allergischen Reaktion zu achten. Falls Symptome einer allergischen Reaktion auftreten, beenden Sie die Injektion und fordern Sie gegebenenfalls Hilfe an.
Beachten Sie bitte auch Abschnitt 2 dieser Packungsbeilage hinsichtlich des Risikos allergischer Reaktionen.
Die folgenden Nebenwirkungen sind sehr häufig (können bei mehr als 1 von 10 Injektionen auftreten):
- Reaktionen an der Injektionsstelle wie Rötung, Schwellung, Juckreiz und Unbehagen.
Die folgenden Nebenwirkungen sind selten (können bei mehr als 1 von 10.000 Injektionen auftreten):
- Kopfschmerzen
- Bauchschmerzen
- Blähbauch
- Erbrechen
- Muskelschmerzen
- Fieber
- Positiver Bluttest auf Antikörper
- Auffallende Ergebnisse bei der Blutuntersuchung, die auf eine Zerstörung von roten Blutkörperchen hinweisen
Bei ähnlichen Medikamenten beobachtete Nebenwirkungen
Die folgenden Nebenwirkungen wurden nach Injektion von subkutanem normalem Immunglobulin vom Menschen beobachtet. Es besteht die Möglichkeit, dass sie auch bei Patienten auftreten, die cutaquig® anwenden.
- Schüttelfrost
- Blässe
- Durchfall
- Juckreiz
- Hautausschlag
- Nesselsucht
- Schmerzen an der Injektionsstelle
- rasche Rötung des Halses/Gesichtsbereichs
- Hitzegefühl
- Frösteln
- Schwäche
- Müdigkeit
- grippeähnliche Symptome
- Unwohlsein
- Engegefühl im Hals
- Atembeschwerden
- asthmaähnliche Symptome
- Husten
- Gesichtsschwellung
- Syndrom namens aseptische Meningitis (siehe auch Abschnitt 2 „Warnhinweise und Vorsichtsmaßnahmen“)
- Erhöhter Blutdruck
- Gerinnsel in den Blutgefäßen (siehe auch Abschnitt 2 „Warnhinweise und Vorsichtsmaßnahmen“)
Informieren Sie umgehend Ihren Arzt, wenn Sie die folgenden Symptome bemerken. Sie könnten Anzeichen eines schwerwiegenden Problems sein.
- Starke Kopfschmerzen mit Übelkeit, Erbrechen, Nackensteifigkeit, Fieber und Lichtempfindlichkeit. Diese könnten Anzeichen einer vorübergehenden und wieder zurückgehenden nicht infektiösen Entzündung der Hirn- und Rückenmarkshäute (Meningitis) sein.
- Schmerzen, Schwellung, Wärmegefühl, Rötung oder eine Geschwulst in Ihren Armen oder Beinen, Kurzatmigkeit ohne erkennbare Ursache, Schmerzen oder Beschwerden im Brustraum, die sich bei tiefem Einatmen verschlimmern, schneller Herzschlag ohne erkennbare Ursache, Taubheitsgefühl oder Schwäche auf einer Körperseite, plötzliche Verwirrtheit oder Probleme beim Sprechen. Diese könnten Anzeichen eines Blutgerinnsels sein.
Derartige Nebenwirkungen können auch dann auftreten, wenn Sie bereits früher mit Immunglobulinen vom Menschen behandelt wurden und diese gut vertragen haben.
Beachten Sie bitte auch die Hinweise unter Abschnitt 2 zu Umständen, die das Risiko von Nebenwirkungen erhöhen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das aufgeführte nationale Meldesystem anzeigen:
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel: +49 6103 77 0
Fax: +49 6103 77 1234
Website: www.pei.de
Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist cutaquig® aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton nach „EXP“ bzw. „verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Im Kühlschrank lagern (2 °C-8 °C). Nicht einfrieren. Die Durchstechflasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
In der Zeit bis zum Ablauf des Verfalldatums kann das Präparat bis zu 9 Monate bei Raumtemperatur (nicht über 25 °C) aufbewahrt werden, ohne es in diesem Zeitraum erneut im Kühlschrank zu lagern, und muss danach bei Nichtgebrauch entsorgt werden.
Nach dem Öffnen einer Durchstechflasche ist die Lösung sofort zu verwenden.
Wenden Sie cutaquig® nicht an, wenn die Lösung trüb ist oder Partikel enthält.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was cutaquig® enthält
Der Wirkstoff ist: normales Immunglobulin vom Menschen 165 mg/ml (mindestens 95 % sind Immunglobulin G)
IgG1 ………… 71 %
IgG2 ………… 25 %
IgG3 ………….. 3 %
IgG4…………… 2 %
Die sonstigen Bestandteile sind: Maltose, Polysorbat 80 und Wasser für Injektionszwecke. Der IgA-Gehalt beträgt maximal 300 Mikrogramm/ml. cutaquig® enthält ≤ 30 mmol/l Natrium.
Wie cutaquig® aussieht und Inhalt der Packung
cutaquig® ist eine Injektionslösung.
Die Lösung ist klar und farblos. Während der Aufbewahrung kann die Lösung leicht opaleszierend und blassgelb werden.
cutaquig® ist erhältlich als:
6, 10, 12, 20, 24 oder 48 ml Lösung in einer Durchstechflasche (Typ-I-Glas) mit einem Bromobutylgummistopfen – Packungsgrößen mit 1, 10 oder 20 Durchstechflaschen. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller
Pharmazeutischer Unternehmer:
OCTAPHARMA GmbH
Elisabeth-Selbert-Str. 11
40764 Langenfeld
info.de@octapharma.com
www.octapharma.de
Hersteller:
OCTAPHARMA GmbH
Elisabeth-Selbert-Str. 11
40764 Langenfeld
Deutschland
Octapharma AB
Lars Forssells gata 23
112 75 Stockholm
Schweden
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Belgien, Bulgarien, Dänemark, Deutschland, Estland, Finnland, Frankreich, Irland, Island, Italien, Kroatien, Lettland, Litauen, Luxemburg, Malta, Niederlande, Norwegen, Österreich, Polen, Portugal, Rumänien, Schweden, Slowakische Republik, Slowenien, Spanien, Tschechische Republik, Ungarn, Vereinigtes Königreich (Nordirland)
Diese Packungsbeilage wurde zuletzt überarbeitet im 01.2022.
Herkunftsland des Blutplasmas:
Deutschland, Estland, Kroatien, Lettland, Litauen, Luxemburg, Norwegen, Österreich, Polen, Portugal, Schweden, Schweiz, Slowenien, Tschechische Republik, Ungarn, USA
Zulassungsnummer: PEI.H.11936.01.1
Anhang I – Anleitung zur Anwendung
1. Bereitstellen der notwendigen Anzahl an Durchstechflaschen mit cutaquig®
- Falls die Durchstechflaschen im Kühlschrank aufbewahrt wurden, müssen Sie diese vor der Injektion auf Raumtemperatur bringen, was mindestens 90 Minuten dauern kann.
- Verwenden Sie dafür keine Wärmequelle und keine Mikrowelle.
- Schütteln Sie die Durchstechflaschen nicht, um Schaumbildung zu vermeiden.
2. Vorbereiten der Injektion
- Bereiten Sie eine saubere Arbeitsfläche unter Verwendung von antiseptischen Tüchern oder einer Desinfektionslösung vor (Abbildung 1).
- Stellen Sie alle Materialien für die Injektion zusammen:
- Injektionspumpe (optional) und passende Spritze(n)
- Kanüle oder belüftete Überleitungssysteme (um die Lösung aus der Durchstechflasche aufzuziehen)
- Nadeln zur subkutanen Injektion
- Alkohol und Alkoholtupfer/antiseptische Tupfer
- Verbandsmull oder durchsichtiger Wundverband und Klebeband
- Behälter für scharfe Gegenstände
- Behandlungstagebuch und Kugelschreiber
- Waschen Sie Ihre Hände gründlich und warten Sie, bis sie trocken sind (Abbildung 2). Verwenden Sie ein Händedesinfektionsmittel, wie es Ihnen während der Schulung gezeigt wurde.
- Falls erforderlich, programmieren Sie die Pumpe gemäß der Bedienungsanleitung und wie es Ihnen während der Schulung von Ihrer medizinischen Fachkraft gezeigt wurde.
3. Überprüfen und Öffnen der Durchstechflaschen
- Führen Sie bei jeder Durchstechflasche folgende Schritte durch:
- Prüfen Sie, ob es sich auf Basis Ihrer Verschreibung um die richtige, auf dem Etikett angegebene Dosis handelt,
- Prüfen Sie das Aussehen der Lösung (sie soll klar und farblos bis blassgelb oder hellbraun sein),
- Vergewissern Sie sich, dass die Schutzkappe nicht beschädigt ist oder fehlt,
- Prüfen Sie das Verfalldatum und die Batchnummer,
- Verwenden Sie die Lösung nicht, wenn sie trüb ist oder Partikel enthält.
- Entfernen Sie die Schutzkappe.
- Desinfizieren Sie den Gummistopfen mit einem antiseptischen Tupfer und lassen Sie ihn trocknen (Abbildung 3).
4. Vorbereiten und Füllen der Spritze
- Öffnen Sie eine sterile Spritze und Kanüle oder das belüftete Überleitungssystem.
- Bei der Nutzung einer Kanüle befestigen Sie diese mit einer Schraubenbewegung an der Spritze. Bei der Nutzung eines belüfteten Überleitungssystems befestigen Sie dieses an der Flasche.
- Bei der Nutzung einer Kanüle ziehen Sie den Spritzenkolben zurück, um die Spritze mit Luft zu füllen. Die Luftmenge sollte in etwa der Menge an Lösung entsprechen, die Sie der Durchstechflasche entnehmen wollen. Bei der Nutzung eines belüfteten Überleitungssystems ist dieser Schritt nicht notwendig.
- Bei der Nutzung einer Kanüle führen Sie diese in die Durchstechflasche ein und drehen Sie die Durchstechflasche um. Injizieren Sie die Luft – achten Sie dabei darauf, dass sich die Nadelspitze nicht in der Lösung befindet, um Schaumbildung zu vermeiden. Bei der Nutzung eines belüfteten Überleitungssystems verbinden Sie die Spritze mit dem Überleitungssystem.
- Anschließend ziehen Sie langsam cutaquig® auf, wobei Sie darauf achten müssen, dass die Kanüle immer in der Lösung bleibt (Abbildung 4).
- Ziehen Sie die Kanüle aus der Durchstechflasche zurück oder lösen Sie die Spritze vom Überleitungssystem.
- Diesen gesamten Vorgang müssen Sie möglicherweise wiederholen, wenn Sie mehrere Durchstechflaschen für die berechnete Dosis benötigen.
- Nach Beendigung des Vorgangs entfernen Sie die Nadel und entsorgen Sie sie in dem Behälter für scharfe Gegenstände.
- Fahren Sie umgehend mit dem nächsten Schritt fort, da die IgG-Lösung sofort verwendet werden soll.
5. Vorbereiten der Injektionspumpe und des Schlauches (optional)
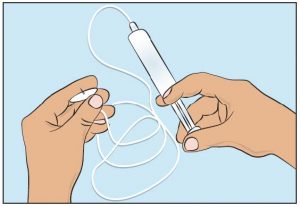
- Befestigen Sie die gefüllte Spritze an die Nadel(n) zur subkutanen Injektion und schieben Sie den Spritzenkolben langsam vor, um den Schlauch mit cutaquig® zu füllen und die Luft zu entfernen (Abbildung 5); die Nadel(n) zur subkutanen Injektion bitte nicht vollständig entlüften.
- Folgen Sie bei der Vorbereitung der Injektionspumpe den Anweisungen des Herstellers.
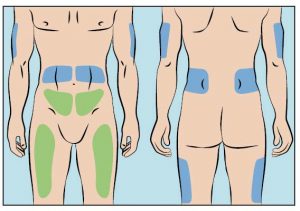
6. Auswahl der Injektionsstellen und Einstechen der Nadel(n) zur subkutanen Injektion
- cutaquig® kann in folgende Bereiche infundiert werden: Bauch, Oberschenkel, Oberarm und/oder seitliche Hüfte (Abbildung 6).
- Der Abstand zwischen den Injektionsstellen sollte mindestens 5 cm betragen.
- Verwenden Sie andere Injektionsstellen als jene, die Sie für die vorangegangene Verabreichung verwendet haben.
- Vermeiden Sie das Einstechen der Nadel in Narben, Tattoos, Dehnungsstreifen oder verletzte/entzündete/rote Hautbereiche.
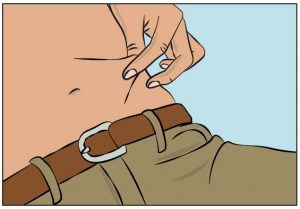
- Reinigen Sie Ihre Haut an Ihrer/n Injektionsstelle/n mit einem antiseptischen Tupfer und lassen Sie die Haut trocknen.
- Drücken Sie die Haut an der Injektionsstelle zwischen Ihrem Daumen und Zeigefinger zusammen (Abbildung 7), entfernen Sie vorsichtig die Nadelabdeckung und stechen Sie die Nadel in die Haut ein (Abbildung 8). Der Winkel der Nadel hängt von der Art der verwendeten Nadel zur subkutanen Injektion ab.
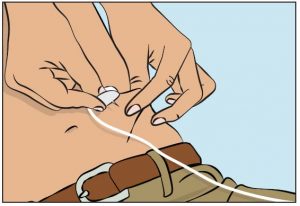
7. Überprüfen der Injektion
- Die Lösung darf nicht in ein Blutgefäß infundiert werden.
- Befestigen Sie die Nadel über der Injektionsstelle mit sterilem Verbandmull und Klebeband oder einem durchsichtigen Wundverband (Abbildung 9).
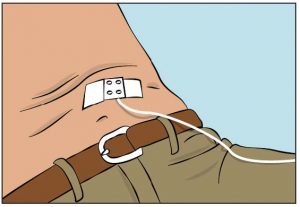
8. Beginnen der Injektion
- Beginnen Sie die Injektion. Falls eine Injektionspumpe verwendet wird, befolgen Sie die Anweisungen des Herstellers.
9. Dokumentation der Injektion
- Auf jeder Durchstechflasche mit cutaquig® finden Sie ein abziehbares Etikett mit der Chargennummer. Kleben Sie dieses Etikett in Ihr Behandlungstagebuch. Tragen Sie nach jeder Injektion Dosis, Datum, Zeit, Lage der Injektionsstelle und etwaige Infektionen oder Nebenwirkungen sowie sonstige Kommentare in Zusammenhang mit dieser Injektion ein.
10. Nach Abschluss der Injektion
- Entfernen Sie behutsam die Nadel(n) und werfen Sie sie sofort in den Behälter für scharfe Gegenstände.
- Falls erforderlich, drücken Sie ein kleines Stück Verbandmull auf die Einstichstelle und legen Sie ein Pflaster an.
- Entsorgen Sie alle gebrauchten Einwegmaterialien sowie nicht verwendetes Arzneimittel und die leere(n) Durchstechflasche(n) wie von Ihrer medizinischen Fachkraft empfohlen und entsprechend den nationalen Anforderungen.
Räumen Sie auf und bewahren Sie alle wiederverwendbaren Materialien (z. B. die Injektionspumpe) sicher bis zur nächsten Injektion auf.